

医药网8月15日讯 体外诊断试剂全国统一编码来了,每个IVD产品都有了唯一一张“身份证”,体外诊断行业从生产、加工到流通、配送、使用全流程可溯源、全过程监管。
IVD行业落地统一编码,罗氏、雅培等巨头企业率先试行!
2019年8月9日,国家药品监督管理局发布一则《关于开展医疗器械唯一标识系统试点工作培训的通知》,(以下简称《通知》)。

《通知》表示为确保《医疗器械唯一标识系统试点工作方案》相关工作顺利开展,国家药监局牵头组织开展对医疗器械唯一标识系统试点培训。培训的对象为医疗器械各个环节上的企业。
非常值得重视的是,在此次有关医疗企业唯一标识系统试点工作名单中,罗氏、雅培、贝克曼、BD、西门子、迪安诊断等IVD国内外巨头赫然在列!
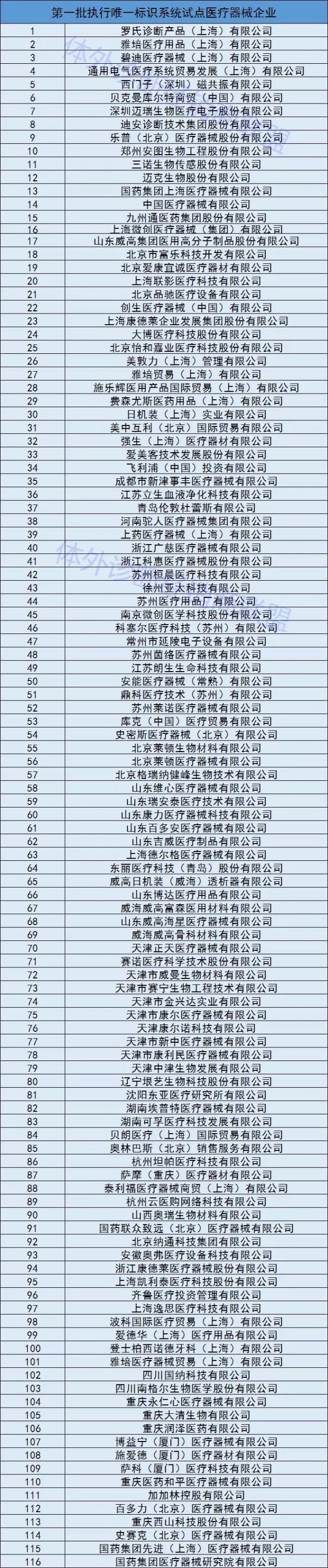
这对于我们IVD行业来说,无疑是吹响了“史上最严监管”的号角!因为在实行IVD产品唯一标识系统后,会生成一个产品编码,这个编码将会从IVD生产、流通、使用等各个环节是实现全程追溯。
并且将会有力推动体外诊断试剂“带量采购”的全面落地。
什么是医疗器械唯一标识?影响所有IVD人!
医疗器械唯一标识系统?:
医疗器械唯一标识(Unique Device Identification,UDI)是美国FDA建立的”特殊医疗器械的识别系统”,是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。
UDI由器械识别码(DI)和生产识别码(PI)组成。器械标识DI属于静态信息,它是医疗器械产品在供应链中的身份标识,可作为进入数据库查询该产品追溯基本信息的“关键字”。
生产标识PI属于动态信息,它包括医疗器械产品的序列号、批号、生产日期和有效期等,是医疗器械产品的动态附加信息,它与DI联合使用,才能指向特定的医疗器械产品。
早前,国家市场总局发布《医疗器械唯一标识系统规则(征求意见稿)》,明确国家药品监督管理局负责建立医疗器械唯一标识系统制度,制定发布医疗器械唯一标识系统实施规划,促进各方积极应用医疗器械唯一标识进行管理,实现数据互联互通。
意味着,未来很可能全国范围内所有IV企业都要执行。并且国家药监总局制定医疗器械唯一标识数据相关标准及规范,组织建立医疗器械唯一标识数据库,供公众查询。
另外,这也就是说医疗器械唯一标识数据库是要向全国公示,所有环节、信息都有据可循、可查。体外诊断行业全供应链的信息都将最大程度上透明化!
医疗器械唯一编码在体外诊断行业如何运行?
就在6月27日,国家医保局发布《医疗保障标准化工作指导意见的通知医保发 [2019] 39号》。
医用耗材编码分5个部分共20位,通过大写英文字母和阿拉伯数字按特定顺序排列表示。其中第1部分是耗材标识码,第2部分是分类码,第3部分是通用名码,第4部分是产品特征码,第5部分是生产企业码。
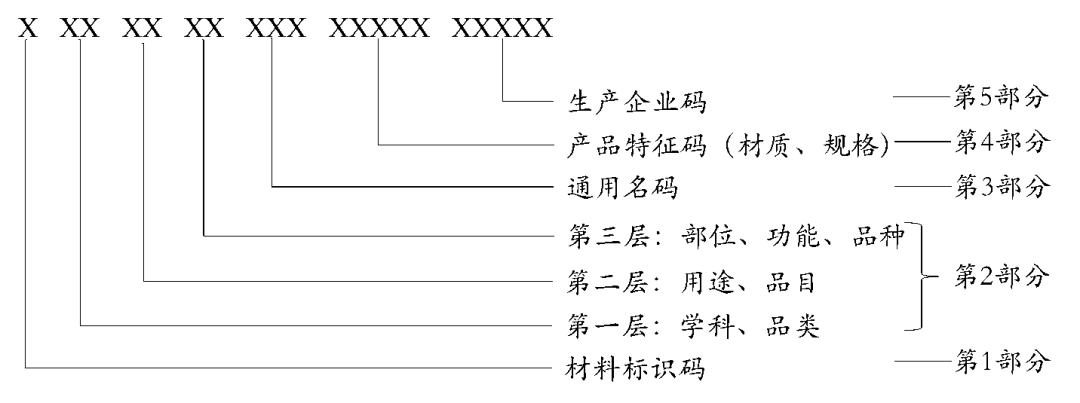
医保医用耗材编码结构

并且国家医保局要求医保医用耗材编码必须具备“唯一性”,实现全国医保系统一码通!一码通还要求能够实现“招采、支付统一”、”支持数据分析共享“、“便于医院临床管理”的功能。

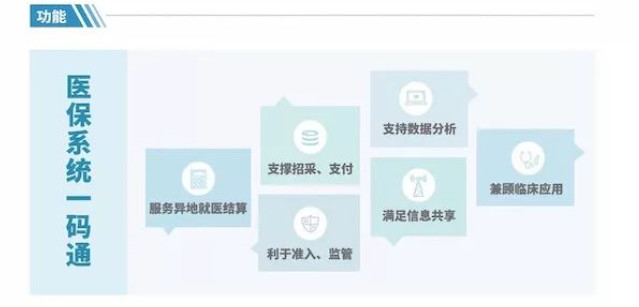

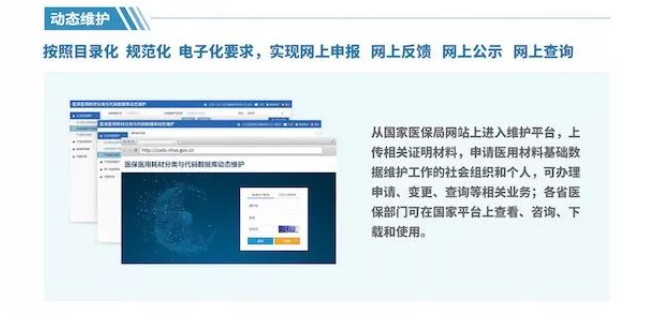
颇有亮点的是,6月27日医保局发布医用耗材统一编码的分类中,并没有明确显示体外诊断产品包含在其中,而仅仅过了一个多月,体外诊断行业就已经要试行唯一标识编码了!这从侧面也反映出,国家政府部门对体外诊断行业的规范化管理正在加深加大!
医疗器械唯一标识编码,推动IVD试剂“带量采购”全面落地!
实现体外诊断医用耗材全国统一编码后,相当于一个体外诊断产品在全国有了唯一一张“身份证”,打通从生产企业内部到流通、使用所有环节的编码、数据接口、电子数据交换等相关信息的接口,实现全国范围内、医疗器械全生命周期内信息可交换。
而通过实现医疗器械唯一标识后,试剂耗材“带量采购”在全国全面落地的速度将会极大加快!
在没有全国统一编码前,体外诊断试剂“带量采购”的标准衡量是一个复杂的过程,因为每个厂家使用的试剂原料、产品核心部件、成本控制等都是不一样的。
而在试行体外诊断产品全国编码时,会按照五级分类编码,逐级递增分别为学科、品类、用途、功能、材质、规格、厂商以及最小包装规格,对不同类别的IVD试剂耗材赋予“唯一”码。
体外诊断全国唯一标识编码,击中了“带量采购”复杂衡量标准的弊端。让体外诊断试剂“带量采购”全面落地的脚步加大加快。
唯一标识编码系统将IVD第三方物流纳入最严监管!
此次《关于开展医疗器械唯一标识系统试点工作培训的通知》不仅有国内外IVD巨头企业,还有国药、九州通等多家知名IVD第三方物流企业。
#p#分页标题#e#
早在2017年2月份,国务院印发的《“十三五”国家食品安全规划和“十三五”国家药品安全规划的通知》中就明确提出,制定医疗器械编码规则,构建医疗器械编码体系。打破生产、经营、使用以及监管各个环节信息闭塞、各自为政的局面。
而在全国各省份,上海2006年就实现植入性医疗器械产品必须使用器械唯一标识编码,并将医院使用数据上传到全市统一的追溯管理系统。
而到了2011年,医疗器械第三方物流储运行为也被纳入其中,流通领域也成为重点监管对象。北京、湖南、河北、辽宁都已经建立起器械物流电子监管平台,重庆建立起“两票制”电子溯源监管系统,加强医疗器械流通追溯环节监管。
此次体外诊断产品统一实施唯一器械标识的试行,将打通这最后一层限制,实现全国,乃至与全球范围内体外诊断产品监管统一。
 乳腺癌容易盯上哪些人?
乳腺癌容易盯上哪些人?  白带发黄是宫颈癌的警示吗?
白带发黄是宫颈癌的警示吗?  超高龄生育,这几件事你准备好了吗?
超高龄生育,这几件事你准备好了吗?  孩子发烧、恶心、呕吐!竟然是心理出了问题
孩子发烧、恶心、呕吐!竟然是心理出了问题  数据显示我国女性平均预期寿命突破80岁
数据显示我国女性平均预期寿命突破80岁  健康早知道:你的子宫还“年轻”吗?
健康早知道:你的子宫还“年轻”吗?  打了胰岛素,血糖为什么没有降?
打了胰岛素,血糖为什么没有降?  多囊卵巢,如何才能尽快怀孕?
多囊卵巢,如何才能尽快怀孕?  女性更年期如何保持健康与美丽?
女性更年期如何保持健康与美丽?  坚持早睡身体会有什么变化?
坚持早睡身体会有什么变化?  抑郁的人,这4类食物尽量少碰,或助改善情绪
抑郁的人,这4类食物尽量少碰,或助改善情绪  多吃3样粗粮,健脾胃,营养滋补暖身
多吃3样粗粮,健脾胃,营养滋补暖身  南京一男子每天1包烟4年2次心梗
南京一男子每天1包烟4年2次心梗  小小“杨桃”是个宝,养颜美容抗疲劳
小小“杨桃”是个宝,养颜美容抗疲劳  多吃三种美食,润肠排毒,美容养颜,滋养子宫
多吃三种美食,润肠排毒,美容养颜,滋养子宫  天天吃二甲双胍,为何血糖不降反升?
天天吃二甲双胍,为何血糖不降反升?